北京百普赛斯生物科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
血液瘤CAR靶点大盘点
499 人阅读发布时间:2022-12-16 13:45
以 Kymriah和Yescarta为代表的多款嵌合抗原受体T细胞(CAR-T)药物相继被批准上市,细胞疗法在血液肿瘤治疗中取得了突破性进展,不断为肿瘤患者带来新希望。研究显示,已有多个细胞表面抗原靶点被发现并被应用于相关的CAR细胞疗法中,如CD19、BMCA等热门靶点,它们在血液系统恶性肿瘤,特别是复发/难治性B细胞恶性肿瘤中取得了巨大的成功,另外,一些针对T细胞恶性肿瘤以及某些顽固型B淋巴细胞肿瘤的相关肿瘤靶点也表现出不错的临床效果,本文小编以血液系统肿瘤为切入点,深度剖析CAR细胞疗法中的热门靶点和相应的临床研究进展。
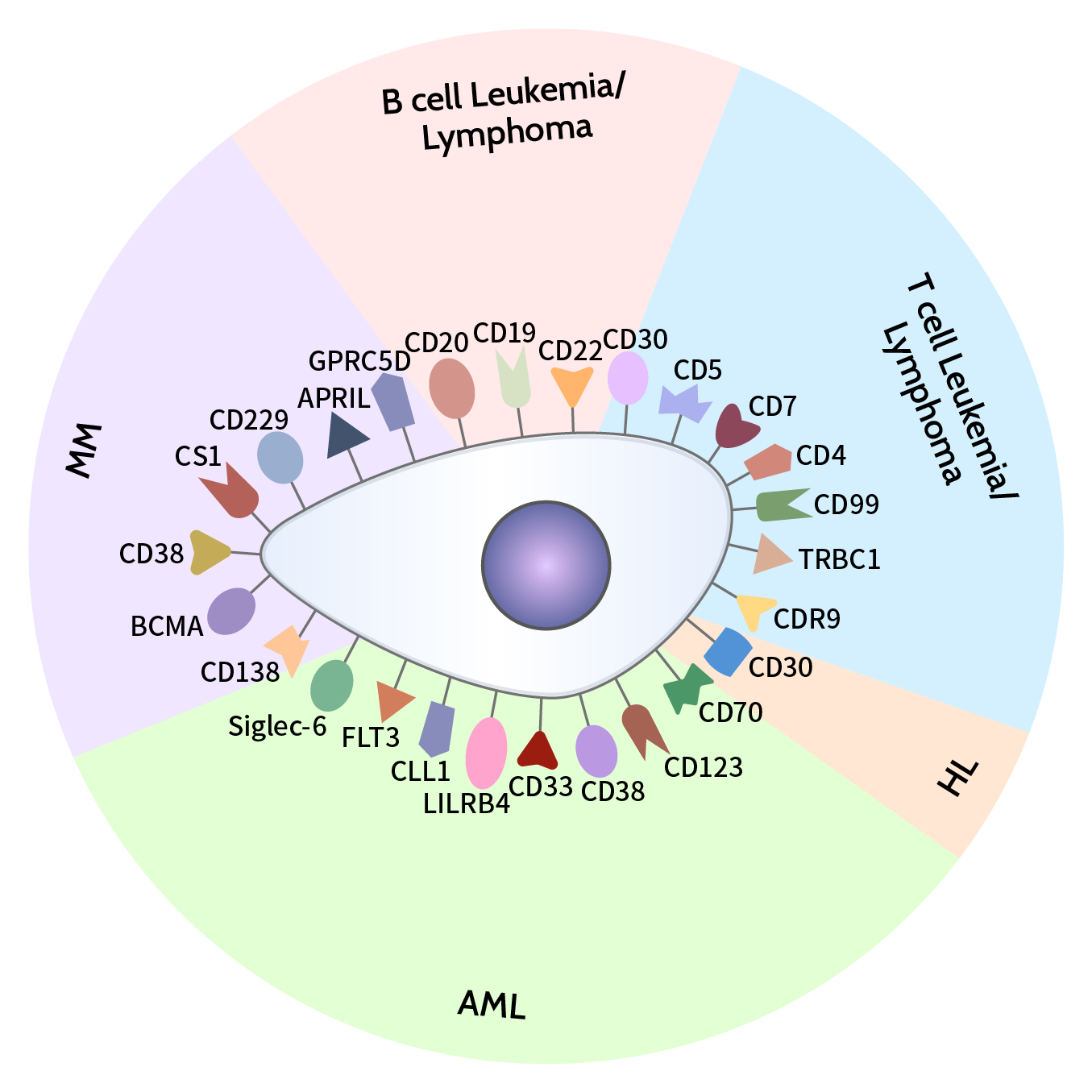
用于治疗不同血液性肿瘤疾病的CAR靶点
B系淋巴细胞白血病/淋巴瘤靶点
CD19 CAR-T细胞疗法在复发/难治性B细胞急性淋巴细胞白血病(R/R B-ALL)和非霍奇金淋巴瘤(NHL)患者中取得了快速和持久的疗效,并极大地改变了B细胞恶性肿瘤的治疗前景,CD19是治疗B细胞恶性肿瘤的重要靶点之一;另外,CD20在超过90%的B细胞淋巴瘤中过度表达,在一项早期临床试验中,抗CD20 CAR-T细胞治疗弥漫性大B细胞淋巴瘤(DLBCL)患者的缓解率为86%。在随后的1期和2期试验中,复发/难治性非霍奇金淋巴瘤(R/R NHL)患者采用了抗CD20 CAR-T细胞治疗,54.5%的患者实现了完全缓解。为了防止抗原逃逸,科学家对CD19和CD20联合CAR-T细胞治疗R/R DLBCL进行了研究,显示出良好临床疗效。此外,CD22在大多数B细胞恶性肿瘤中高度表达,在正常B细胞上限制性表达,在造血干细胞上不表达,也是治疗R/R B-ALL和DLBCL的理想靶点。
T淋巴细胞白血病/淋巴瘤靶点
CD7在95%的T-ALL患者中高表达,是治疗T-ALL的理想靶点,在一项临床试验中,20名R/R T-ALL患者接受供体来源的CD7 CAR-T细胞治疗,90%的患者得到了完全缓解;CD5在大约85%的T细胞恶性肿瘤中表达,如T淋巴母细胞淋巴瘤(T- LBL)和外周T细胞淋巴瘤(PTCL),一名伴有中枢神经系统(CNS)浸润的难治性T-LBL患者接受了抗CD5 CAR-T细胞治疗,并在4周内得到了完全缓解,表明抗CD5 CAR-T细胞可以有效地消除恶性T淋巴瘤细胞;此外,研究发现,抗CD4 CAR-T细胞在对抗T细胞恶性肿瘤中也表现出优越的活性。CD7、CD5、CD4等是作为治疗T细胞淋巴母细胞白血病/淋巴瘤的有力靶点。
霍奇金淋巴瘤靶点
有研究显示,CD30在霍奇金淋巴瘤(HL)中高表达,目前已有一系列临床试验来评估抗CD30 CAR-T细胞治疗R/R HL的安全性和有效性,一项临床试验结果显示,6例HL患者中有5例在输入第三代抗CD30 CAR-T细胞后得到完全缓解,其中3例患者长期缓解超过24个月,表明CD30是作为治疗霍奇金淋巴瘤的潜在靶点。
相关靶点:CD30
急性髓系白血病的靶点
急性髓细胞性白血病(AML)是最常见的急性成人白血病,但由于抗原的异质性,治疗难度相对较大。CD38在大多数AML母细胞上表达,研究表明CD38 CAR-T细胞治疗对异体造血干细胞移植后复发的AML有效;CLL-1是髓系细胞表面标记物,在白血病干细胞上过度表达但在正常的造血干细胞中不存在,也被研究用于治疗AML;CD70在AML母细胞上表达,在正常髓系细胞上不表达,使其成为AML治疗的一个潜在靶点。近年来,CD123、CD33、CD38、CD70、CLL-1、LILRB4、FLT3以及Sigle -6等靶点相继被发现,为治疗急性髓系白血病带来更多选择。
相关靶点:CD123、CD33、CD38、CD70、CLL-1、LILRB4、FLT3、Sigle-6
多发性骨髓瘤靶点
多发性骨髓瘤(MM)是一种浆细胞恶性肿瘤,而BCMA在恶性浆细胞上高度选择性表达,是治疗MM有效靶点之一。目前,BCMA CAR-T细胞治疗已被证明对R/R MM有效,并取得了非常显著的效果,已有两款抗BCMA CAR-T细胞药物被FDA批准用于治疗R/R MM;CD138在MM细胞上高表达,起到促进肿瘤细胞生长和增殖的作用,一项临床前研究显示,CD138 CAR-T细胞可有效消除MM细胞;CD38也在MM细胞上高表达,CD38 CAR-T细胞在小鼠模型中表现出显著的抗肿瘤作用,另外,CD38经常与其他靶点如BCMA、CD138联合使用,用于开发双靶点CAR-T细胞疗法,来降低抗原逃逸的风险。此外,CD229, SLAMF7等相关靶点也被发现有治疗MM的潜力。
相关靶点:CD38、BCMA、CD138、CD229、SLAMF7
为支持CAR细胞疗法在血液系统恶性肿瘤研究进展,ACROBiosystems百普赛斯利用专业的蛋白研发平台、蛋白标记平台、稳定株开发平台和流式细胞分析平台,开发了一系列包括非标记、生物素标记、荧光标记等多种形式的CAR靶点蛋白,可用于免疫、筛选、亲和力检测以及CAR检测质控等研究,全面加速您的CAR细胞疗法药物开发进程。
| CD19 | CD20 | CD22 | BCMA |
| CD7 | CD5 | CD4 | CD30 |
| CD123 | CD33 | CD38 | CD70 |
| CD138 | CD99 | CLL-1 | Sigle-6 |
| LILRB4 | CD72 | ... | ... |
产品特色
★ Alexa Fluor 647\555\488、APC、PE、FITC等多种标记类型
★ 高生物活性经ELISA、SPR、FACS等验证
★ 部分产品完成FDA DMF备案,支持IND、BLA申报
产品数据
✍ AF488荧光标记 BCMA蛋白可高活性检测BCMA CAR表达
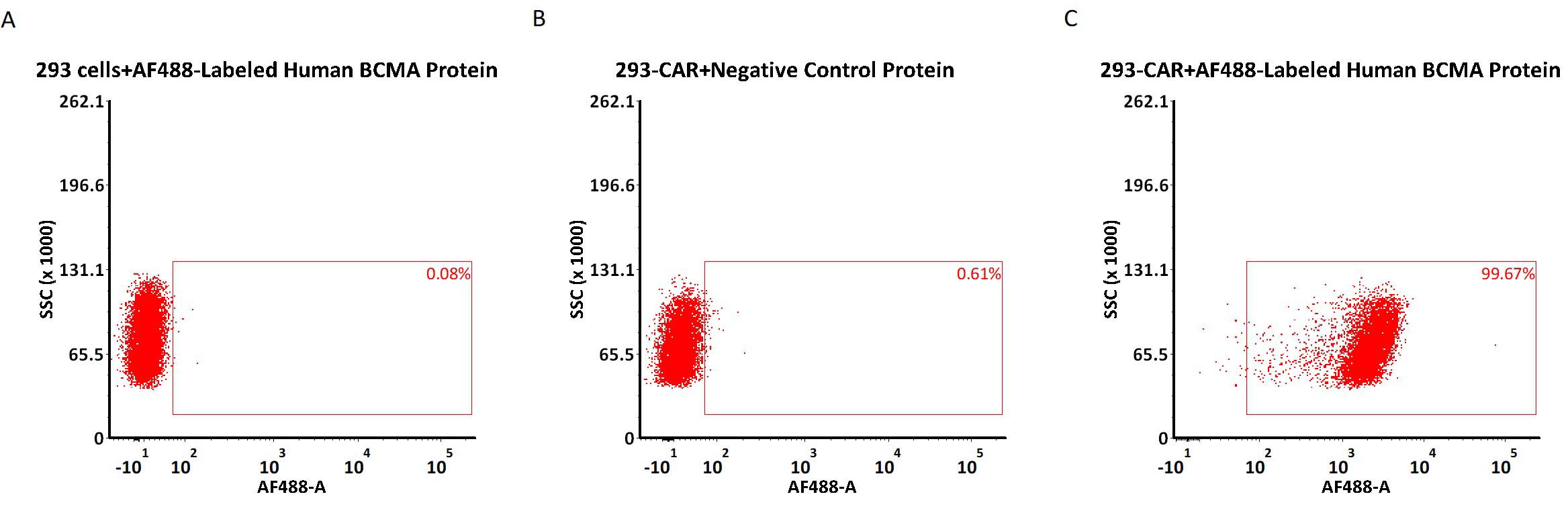
5e5 of anti-BCMA CAR-293 cells were stained with 100 μL of 1 μg/mL of AF488-Labeled Human BCMA, His Tag (Cat. No. BCA-HA2H8) and negative control protein respectively (Fig. C and B), and non-transfected 293 cells were used as a control (Fig. A). AF488 signal was used to evaluate the binding activity (QC tested).
✍ PE荧光标记CD19经流式验证适用于Anti-CD19 CAR阳性表达率检测
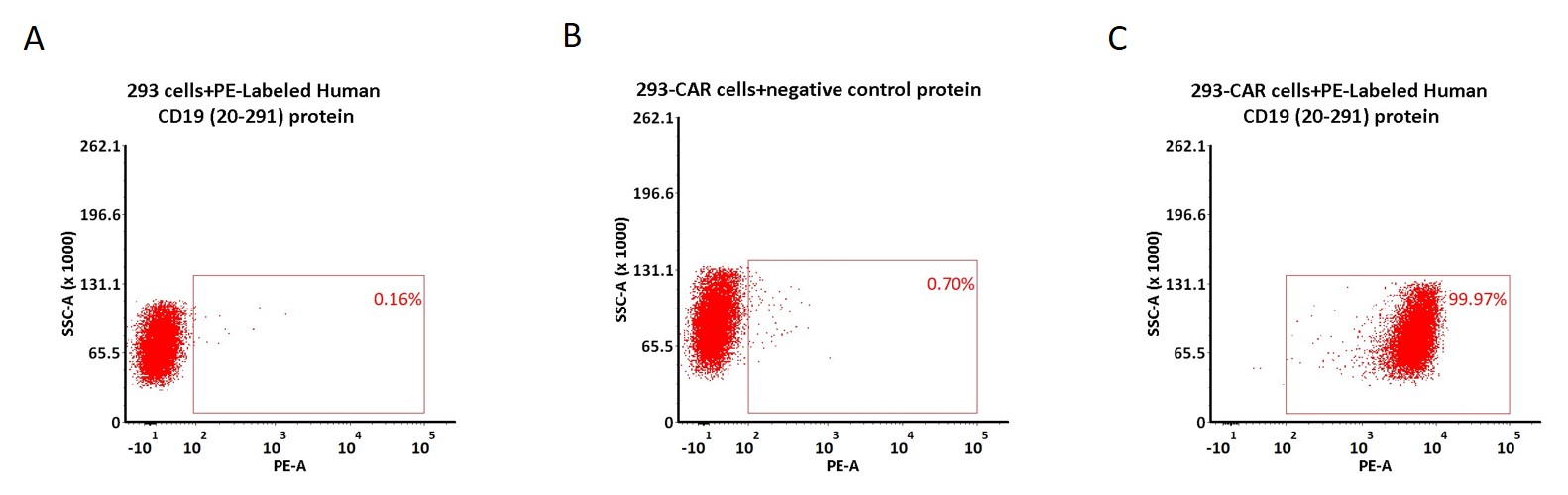
5e5 of anti-CD19 CAR-293 cells were stained with 100 μL of 1:50 dilution (2 μL stock solution in 100 μL FACS buffer) of PE-Labeled Human CD19 (20-291), His Tag (Cat. No. CD9-HP2H5) and negative control protein respectively (Fig. C and B), and non-transfected 293 cells were used as a control (Fig. A). PE signal was used to evaluate the binding activity (QC tested).
精彩瞬间
2022年12月9日,ACROBiosystems百普赛斯高级产品开发经理姚伟丽出席了BioCMC2022第六届中国生物药CMC国际峰会,并分享了《细胞治疗药物CMC工艺开发中的关键原料选择》精彩演讲,探讨了:
1)全球细胞治疗药物的研发现状及发展趋势;
2)CMC生产阶段面临的风险挑战和法规要求;
3)GMP级别核心原料在细胞治疗药物CMC生产中的重要影响和选择关键点。
点击下方按钮登录即可观看视频回放、下载PPT~


ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)
参考文献
1. Zhang X, Zhu L, Zhang H, Chen S, Xiao Y. CAR-T Cell Therapy in Hematological Malignancies: Current Opportunities and Challenges. Front Immunol. 2022 Jun 10;13:927153. doi: 10.3389/fimmu.2022.927153. PMID: 35757715; PMCID: PMC9226391.



