北京百普赛斯生物科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
ACRO助力攻克“静默威胁”:尼帕病毒疫苗研发新范式
15 人阅读发布时间:2026-01-30 18:28
尼帕病毒(Nipah Virus Disease)疫情升级,印度南部实施严格管控
印度喀拉拉邦近日暴发新一轮尼帕病毒疫情,目前已确认6例病例,其中2例死亡。疫情集中在科泽科德地区,当局已迅速划定 7个高风险村庄作为隔离区,并宣布关闭该地区所有学校、办公场所及公共交通至少至本周末。

2026年1月,印度东部的西孟加拉邦出现尼帕病毒感染病例
印度尼帕病毒疫情最-新进展表明,东部西孟加拉邦已报告至少1例实验室确诊的尼帕病毒感染病例,该患者近期有喀拉拉邦旅行史,目前已被隔离治疗。这是本次疫情首次从南部的喀拉拉邦扩散至其他邦,显示病毒可能存在跨区域传播风险。
尼帕病毒病(Nipah Virus Disease)是由尼帕病毒(Nipah virus,NiV)感染引起的一种急性、高度致死性人畜传染病。该病毒可导致人类中枢神经系统和呼吸系统严重受累,临床表现包括急性脑炎、急性呼吸窘迫综合征等。在历次爆发事件中,其病死率高达40%–75%。
国际病毒分类委员会(ICTV)将尼帕病毒归类为副黏病毒科(Paramyxoviridae)亨尼帕病毒属(Henipavirus)。由于其高致病性且缺乏特-效药,活病毒操作必须在最高防护等级的生物安全四级(BSL-4)实验室中进行。
自 1998 年首次在马来西亚暴发以来,新加坡、孟加拉国、印度和菲律宾等多国相继出现人间或人畜共患疫情,呈现出“多点散发与局部高致死并存”的流行特征。近期,印度西孟加拉邦再次报告感染病例,部分患者病情危重,密切接触者已被实施居家隔离。受区域人口流动影响,泰国普吉等周边旅游热门地区也加强了针对性健康监测。这些散发或小规模聚集性疫情时刻提醒我们:尼帕病毒仍是一个不容忽视的公共卫生“静默威胁”。
从病毒结构与入侵机制来看,NiV 表面的两类糖蛋白是疫苗设计和中和抗体研发的关键:
> 附着糖蛋白G(Attachment Glycoprotein G):负责识别并结合宿主细胞受体Ephrin-B2/B3,就像“钥匙”识别“锁孔”,是介导病毒附着的第一步。它是目前大多数候选疫苗的主抗原,也是多株中和抗体的主要靶点。
> 融合糖蛋白F(Fusion Glycoprotein F):负责介导病毒包膜与宿主细胞膜的融合,就像“撬开”细胞的大门。F蛋白存在融合前(Pre-fusion)与融合后(Post-fusion)两种构象。其中,融合前构象可暴露出一系列相对保守且糖基化较少的表位,是广谱中和抗体和结构疫苗设计的重点关注对象。
近期,围绕这两类糖蛋白的结构与功能研究取得了突破性进展,为通用亨尼帕病毒(Henipavirus)疫苗和广谱抗体的研发提供了重要线索。
2025 年 8 月 29 日,北京生物工程研究所陈薇团队在 Signal Transduction and Targeted Therapy 在线发表了题为《Single amino acid substitution in Hendra virus attachment glycoprotein induces cross-neutralizing antibodies against Nipah virus》的研究论文。该研究以 NiV附着糖蛋白G为切入点,解析了一个关键的易损表位,并通过结构重构策略,成功将这一表位“移植”到同属的亨德拉病毒(Hendra virus, HeV)G蛋白上,从而获得了可诱导广谱中和应答的新型抗原。主要发现包括:
-
鉴定NiV-G 上的易损中和表位与 14F8 抗体: 研究团队筛选获得了一株强效中和抗体 14F8。该抗体针对NiV-G受体结合区的一个独特易损表位,能有效阻断病毒与受体 Ephrin-B2 的结合。晶体结构解析(2.8 Å)精确描绘了这一关键的抗原-抗体界面。
-
“单氨基酸替换”重建广谱表位: 基于结构分析,研究者在HeV-G的第586位引入 S586N替换。晶体结构显示,这一单点突变引发了局部构象重排(约9 Å),神奇地重塑了分子骨架,使其在空间构型上完美模拟了 NiV-G的14F8识别表位。这体现了结构生物学在表位重构中的精细与奥妙。
-
HeV-G^S586N 作为广谱免疫原的潜力: 在小鼠和食蟹猴模型中,该突变体抗原诱导出了针对NiV与HeV的广泛中和抗体反应。与野生型相比,其在初次免疫后即可产生更高的中和滴度。这也意味着,HeV-G^S586N有望成为设计通用疫苗的范例抗原。
F 蛋白研究:融合前构象上的保守表位支撑广谱中和
另一项发表于Antiviral Research的研究(Li T. 等,2025)则聚焦于 NiV 融合糖蛋白 F,系统评估了针对 F 蛋白的单克隆抗体谱。该研究的关键要点包括:
> 高效抗NiV-F 单抗的发现: 研究者筛选出的多株单克隆抗体,在假病毒体系中显示出极强的中和能力(EC50 处于 ng/mL 级别)。
> 广谱交叉中和能力的验证: 部分抗体(如 NiF03-3C9、NiF03-2F6)不仅能高效中和 NiV,对多种 HeV 变异株的中和能力甚至更强。这提示 F 蛋白上存在跨物种的、相对保守的功能性表位。
> 融合前F 三聚体侧面保守表位的解析: 冷冻电镜结构显示,广谱抗体结合于F三聚体融合前构象的侧面区域。该区域在 NiV 与 HeV 之间高度保守。这表明,锁定融合前构象是设计广谱疫苗的关键,这类抗体主要通过阻断 F 蛋白的构象变化来发挥保护作用。
总结来看,G与F在免疫干预中分工明确:
-
G蛋白:侧重于“附着阻断”,针对受体结合位点。
-
F蛋白(尤其是融合前构象):提供了跨毒种、跨变异株的“广谱打击”靶点。
工欲善其事|ACRO NiV/HeV 结构确证抗原与抗体组合定制方案
上述研究清晰地表明,针对 NiV/HeV 的研发正在从“从无到有”走向“构象与表位精细化”的新阶段。
为助力科研工作者在这一高致病性领域安全、高效地开展研究,ACROBiosystems 百普赛斯立足结构生物学设计理念,打造全谱亨尼帕病毒(Henipavirus)核心试剂体系,全覆盖关键附着蛋白、攻克融合蛋白构象锁定难题,重磅推出结构与功能一体化的全套抗原抗体解决方案:
1. 高质量重组抗原系列
我们提供高纯度、构象正确的重组蛋白,全面覆盖病毒入侵的关键环节:
-
NiV G蛋白(可溶性胞外域):保持天然受体结合活性,是受体阻断实验、中和抗体筛选及表位精细分析的首-选抗原。
-
NiV F蛋白(融合前构象 / Pre-fusion):通过特定的序列优化稳定了不稳定的融合前构象,这是筛选和表征真正具有广谱保护意义中和抗体的核心工具。
-
NiV F 蛋白(融合后构象 / Post-fusion):作为不可或缺的构象对照,用于剔除无保护作用的非特异性抗体,并辅助解析病毒融合机制。
点击货号查看Nipah抗原蛋白详情
| 分子 | 货号 | 产品描述 |
|
Glycoprotein G (NiV) |
GLN-N52H3 |
Nipah virus Glycoprotein G, His Tag (MALS verified) |
|
NA |
Biotinylated Nipah virus Glycoprotein G glycoprotein, His,Avitag在研 |
|
|
Prefusion glycoprotein F0/pre-F protein (NiV) |
FUN-N52H3 |
Nipah virus Pre-Fusion glycoprotein, His Tag (MALS verified) |
|
NA |
Biotinylated Nipah virus Pre-Fusion glycoprotein, His,Avitag在研 |
|
|
Postfusion glycoprotein F0/post-F protein (NiV) |
PON-V52H3 |
Nipah virus Post-Fusion glycoprotein, His Tag (MALS verified) |
|
PON-V82E3 |
Biotinylated Nipah virus Post-Fusion glycoprotein, His,Avitag™ (MALS verified) |
2. 及其配套的单克隆抗体对照
为了配合抗原的验证与检测方法的建立,我们同时提供针对不同靶点的人 IgG1 单克隆抗体:
-
抗NiV G蛋白单抗:用于构建标准曲线及竞争性抑制实验。
-
抗NiV F蛋白单抗:可作为特异性结合对照,用于区分抗体的交叉反应性与构象特异性。
点击货号查看Nipah抗体产品详情
| 分子 | 货号 | 产品描述 |
|
Glycoprotein G (NiV) |
GLN-MY2258 |
Monoclonal Anti-Nipah virus (NiV) Glycoprotein G Antibody, Human IgG1 (4B8) (MALS verified) |
|
GLN-MY2257 |
Monoclonal Anti-Nipah virus (NiV) Glycoprotein G Antibody, Human IgG1 (5G9) (MALS verified) |
|
|
Postfusion glycoprotein F0/post-F protein (NiV) |
NIN-M760 |
Monoclonal Anti-Nipah Post Fusion glycoprotein Antibody, Human IgG1 (3C3) (MALS verified) |
|
NIN-M759 |
Monoclonal Anti-Nipah Post Fusion glycoprotein Antibody, Human IgG1 (2B2) (MALS verified) |
|
|
Fusion glycoprotein |
FUN-MY2097 |
Monoclonal Anti-Hendra virus F glycoprotein Antibody, Human IgG1 (1A7) (MALS verified) |
|
FUN-MY2098 |
Monoclonal Anti-Hendra virus F glycoprotein Antibody, Human IgG1 (3F4) (MALS verified) |
尼帕病毒作为WHO 优先病原体之一,其在南亚地区的持续散发使其始终处于全球公卫的“雷达监测范围”内。2025 年以来的最-新研究成果——无论是G蛋白易损表位的精细重构,还是F蛋白融合前构象保守表位的发现——正在逐步将尼帕病毒的免疫干预从“概念可行”推向“结构可设计”。在这一进程中,高质量的G蛋白与F蛋白(特别是融合前/后构象)抗原及配套抗体,将是连接基础研究与疫苗落地应用的关键桥梁。对于致力于应对这一“静默威胁”的科研团队而言,善用这些结构化工具,将是决胜下一阶段研发的关键。
👉 Nipah病毒Pre-Fusion G蛋白:经SDS-PAGE验证>90%,SEC-MALS验证>90%,具备高纯度
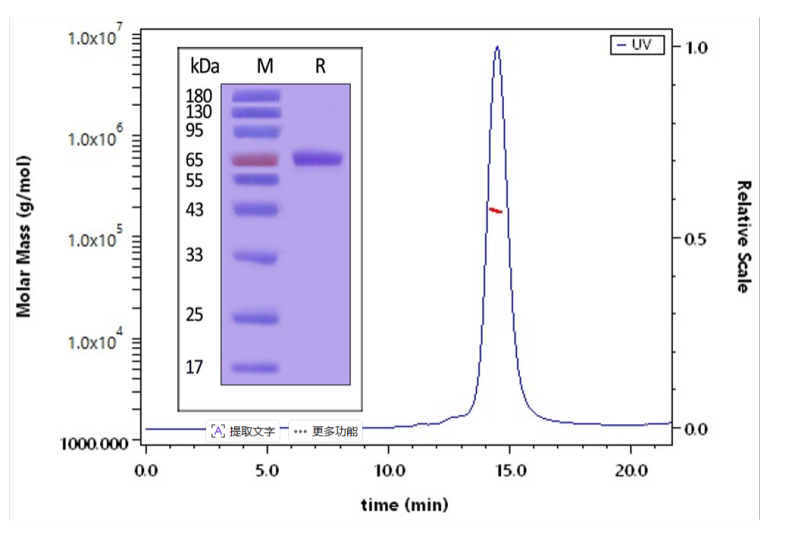
The purity of Nipah virus Pre-Fusion glycoprotein, His Tag (Cat. No. FUN-N52H3) is greater than 90% verified by SDS-PAGE and more than 90% verified by SEC-MALS.
👉 Nipah病毒G蛋白:经ELISA验证,具备高生物活性
Immobilized Nipah virus Glycoprotein G, His Tag (Cat. No. GLN-N52H3) at 5 μg/mL (100 μL/well) can bind Human Ephrin-B2 Protein, Fc tag (Cat. No. EPN-H5259) with a linear range of 0.1-2 ng/mL (QC tested).
👉 抗Nipah病毒Post Fusion G蛋白单抗:经SPR验证,具备高亲和力
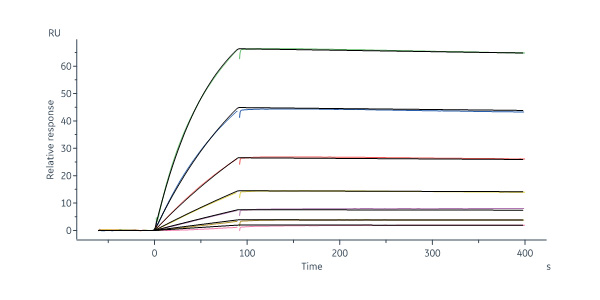
Monoclonal Anti-Nipah Post Fusion glycoprotein Antibody, Human IgG1 (3C3) (Cat. No. NIN-M760) captured on Protein A Chip can bind Nipah virus Post-Fusion glycoprotein, His Tag (Cat. No. PON-V52H3) with an affinity constant of 0.937 nM as determined in a SPR assay (Biacore 8K) (Routinely tested).
参考资料:
1. Li Y, Huang X, Li R, Zai X, Yang Y, Zhang Y, Zhang Z, Zhang J, Xu J, Chen W. Single amino acid substitution in Hendra virus attachment glycoprotein induces cross-neutralizing antibodies against Nipah virus. Signal Transduction and Targeted Therapy. 2025;10:276. DOI: 10.1038/s41392-025-02370-0
2. Li T, Xu H, Zhang M, Nie J, Liao B, Xie J, Jiang Y, Liu Y, Ge P, Zhao C, Sun Z, Bai Y, Tang M, Su X, Wang Y, Huang W. A monoclonal antibody targeting conserved regions of pre-fusion protein cross-neutralizes Nipah and Hendra virus variants. Antiviral Research. 2025;240:106215. DOI: 10.1016/j.antiviral.2025.106215

ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)



