北京百普赛斯生物科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
抗体开发早期为何必须全面评估Fc介导的效应功能?
392 人阅读发布时间:2025-09-05 15:55
ADC药物的核心作用机制——内吞作用是将毒性药物精准递送至肿瘤细胞,能够极大降低药物对正常组织的毒性。因此ADC的内吞活性需要强有力的筛选方法。
ACROBiosystems百普赛斯开发并验证了一种利用pH敏感的内吞检测试剂,适用于快速评估抗体的内吞过程。本文展示了该试剂用于荧光显微镜成像以及流式细胞术两种方法评估HER2 阳性贴壁细胞和 CD20 阳性悬浮细胞中的抗体内化水平的结果,探究了试剂浓度、孵育时间等关键实验参数,并评估了这些参数对荧光信号和内吞效率的影响。
产品推荐:pH敏感的ADC内吞检测试剂 (Cat. No. IGG-PZF2001)
内吞作用检测试剂特异性验证
检测方法:荧光显微镜成像
检测仪器:EVOS M7000 成像系统
细胞:SK-BR-3
1. 细胞培养:使用含 10% 胎牛血清(CellMax)的 DMEM 培养基,在 37°C、5% CO₂的 CO₂培养箱中培养SK-BR-3细胞。
2. 收获细胞并计数细胞数量和活力。
3. 细胞铺板:收获细胞,将细胞以7×104个细胞/孔的密度铺板于24孔培养板中;培养箱中孵育过夜。
4. 制备4×抗体工作液(8 µg/mL),制备4×内吞检测试剂工作液(4 µg/mL),1:1混合,室温孵育10分钟,使标记复合物形成。
5. 每个孔中加入500µL标记复合物(来自步骤4),4°C下孵育60 min。移除上清液,PBS洗涤三次后每孔中加入1 mL测定培养基。
6. 将CellLight™ Lysosomes-GFP添加到每个孔中,并在培养箱中(37°C、5% CO₂)孵育细胞16小时。
7. 将NucBlue™ Live ReadyProbes™添加到每个孔中,并在室温下孵育细胞20分钟。
8. 使用EVOS M7000成像系统分析细胞。
荧光显微镜观察显示,仅实验组细胞的内体区室中出现强荧光信号(图1C);而对照组(无抗体组或加入同型对照抗体组)仅呈现极低水平的背景信号(图1A-B)。这种依赖抗体的荧光分布模式清晰表明,内吞作用信号是由靶标抗体结合特异性介导产生的。Z 轴堆叠扫描进一步证实了这一结论:结果显示内吞作用试剂信号(红色)与溶酶体标志物(绿色)存在高度共定位,且未检测到细胞外信号(图 1D)。
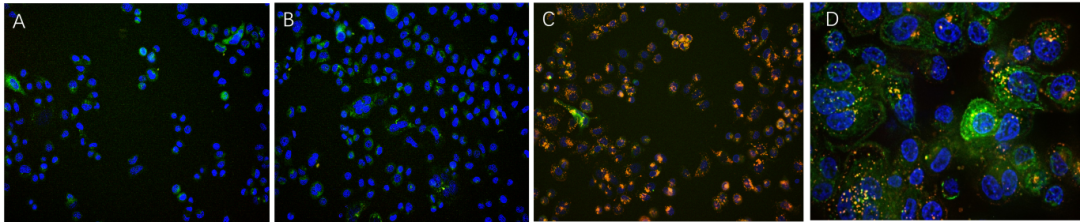
图1 A,内吞作用检测试剂(货号:IGG-PZF2001)
B,IgG1 同型对照抗体 - 内吞作用检测试剂偶联物
C,抗 HER2 抗体 - 内吞作用检测试剂偶联物
D,抗 HER2 抗体 - 内吞作用检测试剂偶联物(Z 轴堆叠扫描成像)
流式细胞术检测ADC内吞作用
此外,我们在HER2 阳性和 CD20 阳性两种细胞系中均开展了流式细胞术分析。
检测方法:流式细胞术
检测仪器:BD Biosciences FACS Lyric
细胞:SK-BR-3、Raji
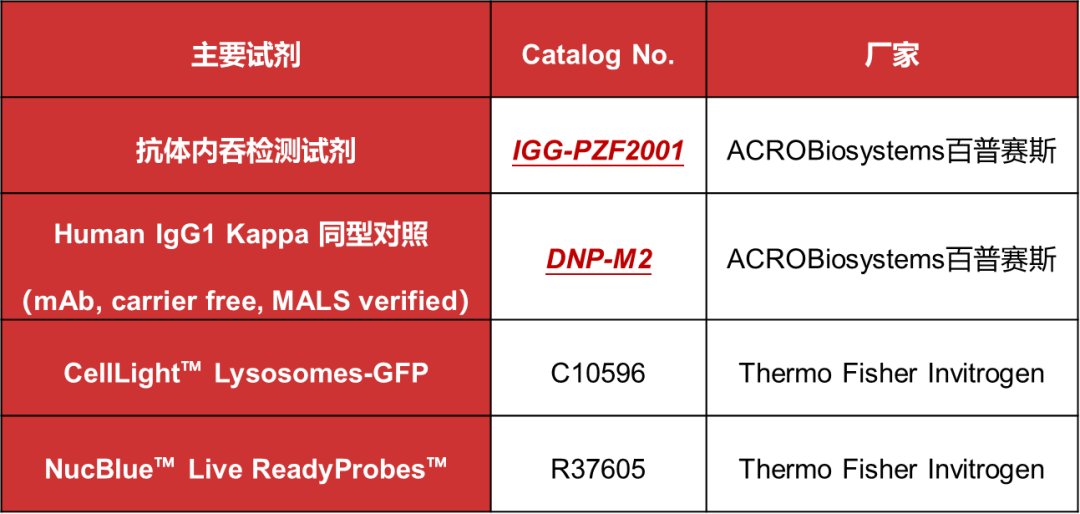
主要试剂:

1. 制备足量的anti-human HER2 antibody 4×浓度工作液(8 µg/mL),溶剂为细胞培养基;制备抗体内吞作用检测试剂 4×浓度工作液(4 μg/mL);1:1加入96孔板中,每孔50 μL,室温下孵育 10 分钟,使标记复合物形成。
2. 用细胞培养基将悬浮细胞浓度调整至 2×10⁶个 / mL。
3. 向抗体内吞作用检测试剂偶联物的 96 孔板每孔加入 50 μL细胞悬液。
4. 在 37℃条件下孵育 2 小时,收集细胞;用流式细胞术缓冲液(FACS buffer)清洗细胞 3 次,随后将细胞重悬于 200 μL PBS中,通过流式细胞术检测。
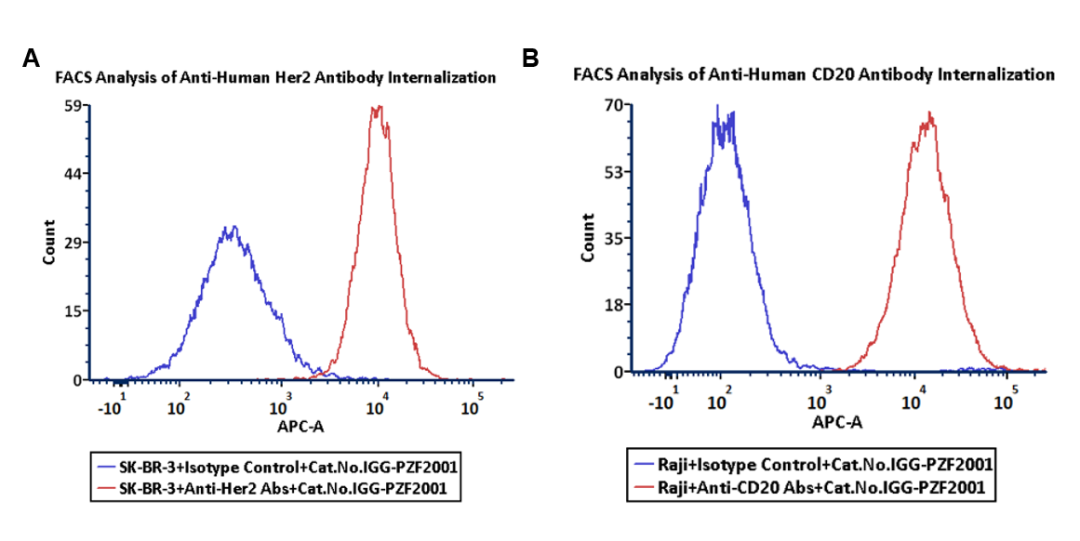
图2 抗体内吞作用的流式细胞术(FACS)分析
A. HER2 阳性细胞系中 HER2 特异性抗体曲妥珠单抗(红色)的检测结果
B. CD20 阳性细胞系中 CD20 特异性抗体利妥昔单抗(红色)的检测结果。
蓝色:IgG1 同型对照抗体的检测结果
结果表明,该内吞作用检测试剂不仅适用于多种细胞类型的抗体内吞评估,还可通过流式细胞术实现快速且定量的分析(图2A-B)。
内吞检测试剂浓度优化
为确定最佳工作浓度,我们在 CD20 阳性和 HER2 阳性细胞系中对该内吞作用检测试剂进行了系统性评估:将一抗浓度固定为 2 µg/mL,同时设置检测试剂浓度为 1 µg/mL、2 µg/mL和 4 µg/mL三个梯度。剂量依赖性分析结果显示,当检测试剂浓度从 1 µg/mL提升至 4 µg/mL时,阳性信号显著增强;不过,较高浓度(4 µg/mL)同时也会导致对照组的背景信号升高。通过综合的信噪比(SNR)分析,我们发现,在这两种细胞系中,1: 2 的比例(即 1 µg/mL检测试剂与 2 µg/mL抗体搭配)能够在检测灵敏度与背景信号抑制之间实现最佳平衡(图 3 A-D)。这一优化后的条件为后续的内吞作用检测实验建立了一套可靠且经济高效的实验方案。
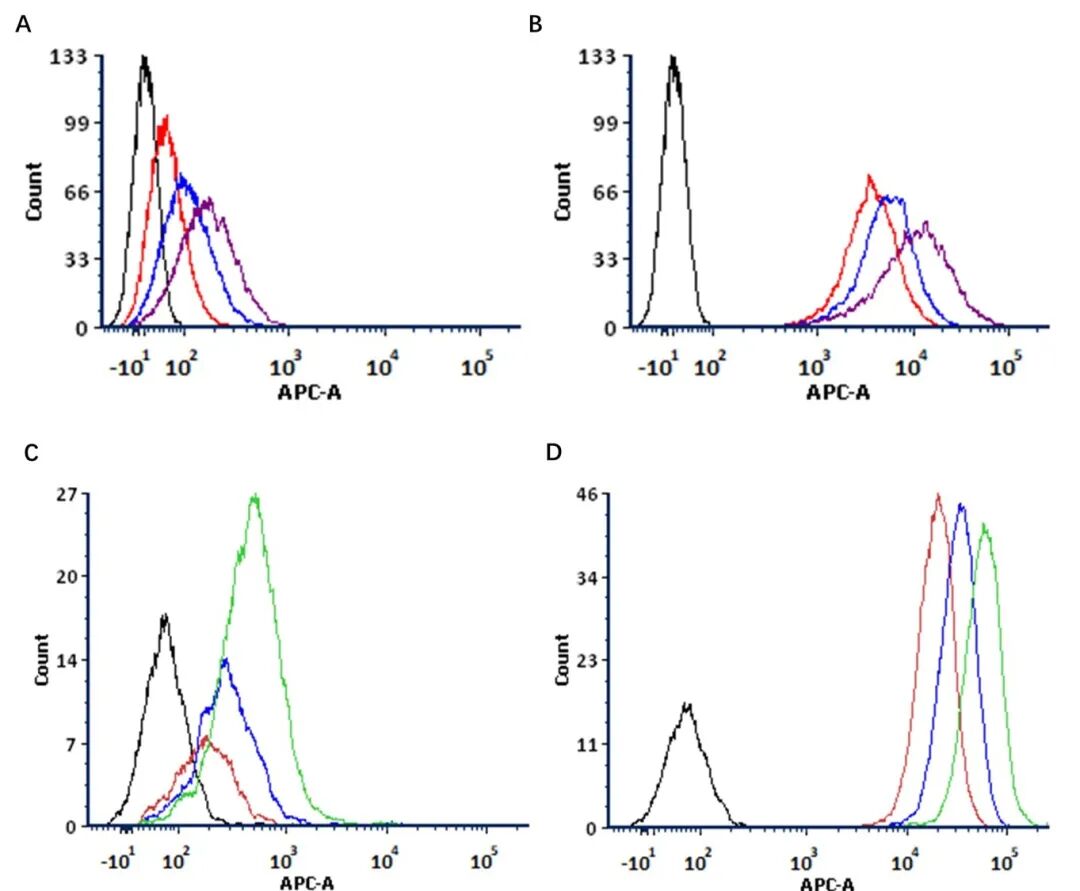
图3 不同检测试剂浓度下抗体内吞作用的流式细胞术(ACS)分析。
A:CD20 阳性细胞系中的检测试剂对照组;
B:CD20 阳性细胞系中检测试剂与 CD20 特异性抗体利妥昔单抗(Rituximab)共孵育组;空白组(Blank):仅含细胞;红色(Red):1 μg/mL检测试剂;蓝色(Blue):2 μg/mL检测试剂;紫色(Purple):4 μg/mL检测试剂;
C:HER2 阳性细胞系中的检测试剂对照组;
D:HER2 阳性细胞系中检测试剂与 HER2 特异性抗体曲妥珠单抗(Trastuzumab)共孵育组;空白组(Blank):仅含细胞;红色(Red):1 μg/mL检测试剂;蓝色(Blue):2 μg/mL检测试剂;绿色(Green):4 μg/mL检测试剂
内吞检测试剂孵育时间优化
我们通过将抗体-试剂复合物与CD20阳性和HER 2阳性细胞系孵育30分钟至4小时,然后进行流式细胞术分析,研究了抗体内吞的动力学曲线,结果表明内吞动力学具有细胞类型依赖性:在整个孵育期间,CD20阳性细胞的荧光强度呈线性增长;而 HER2阳性细胞则表现出双相反应特征——前2小时信号变化极小,在4小时时信号显著增强(图4 A-D)。这些不同的动力学模式证实了我们的内吞检测试剂可通过定量荧光变化可靠地监测动态内吞过程,同时还能揭示内吞速率的靶标特异性差异。
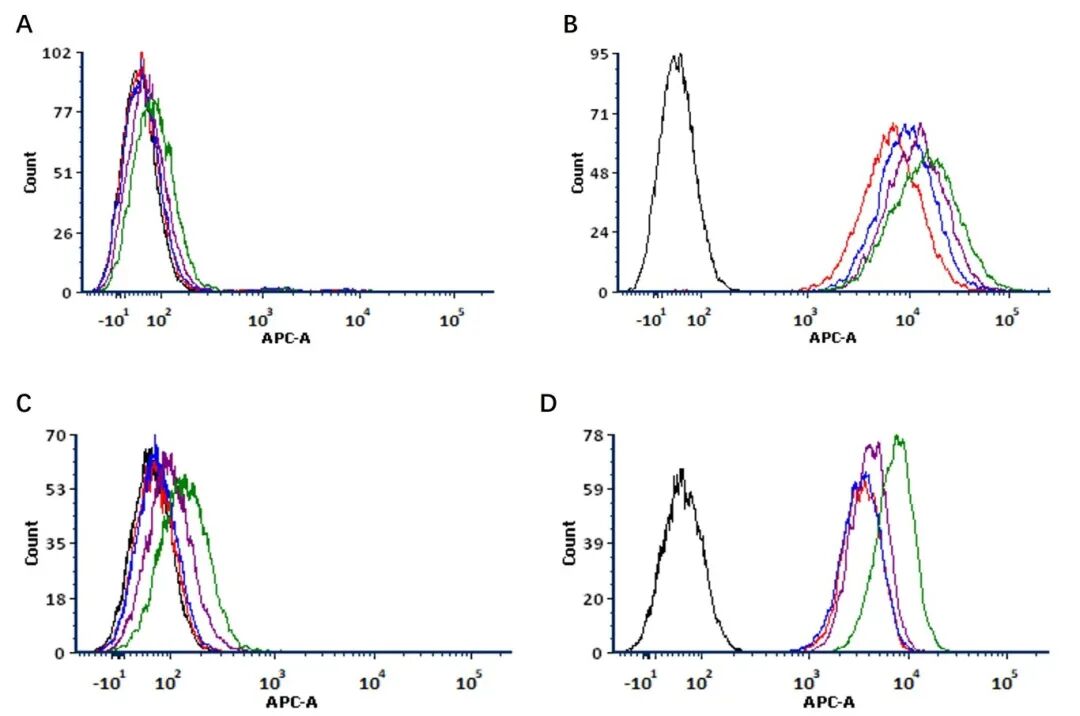
图4 不同孵育时间下抗体内吞的FACS分析。
A:CD 20+细胞系中的检测试剂对照。B:CD 20+细胞系中的检测试剂和CD 20特异性抗体利妥昔单抗。C:HER2+细胞系中的检测试剂对照。B:HER2+细胞系中的检测试剂和HER2特异性抗体曲妥珠单抗。空白:仅细胞。红色:30 min,蓝色:1 h,紫色:2 h,绿色:4 h。
本研究结果强调了建立细胞系特异性检测窗口的重要性,因为最佳检测时间点可能会因靶抗原和细胞环境的不同而存在显著差异。这种时间特征分析为未来应用中的实验设计提供了关键指导,同时也强调:对于每一种新的抗体-细胞系统组合,都应通过实验确定其内吞动力学,以确保准确评估内吞效率。


ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)



