北京百普赛斯生物科技股份有限公司品牌商
14 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
推荐产品
公司新闻/正文
Tau PFFs与脑类器官共培养在神经退行性疾病研究中的应用
297 人阅读发布时间:2025-08-21 15:27
本研究结合Tau预制前体纤维(Pre-formed Fibrils, PFFs)和人诱导多能干细胞(iPSC)来源的脑类器官,建立了一种体外模型,以探究阿尔茨海默病(AD)及其他Tau蛋白病的致病机制及潜在的治疗干预措施。AD作为一种进行性神经退行性疾病,其特征性病理包括淀粉样斑块和病理性Tau蛋白形成的神经纤维缠结,这些Tau蛋白通过“种子化”作用在受体神经元中诱导内源性Tau蛋白聚集,并以朊病毒样方式在大脑中传播,导致突触损失和认知功能衰退。iPSC分化的脑类器官能够高度模拟人类大脑皮层发育的三维结构和细胞多样性,为神经退行性病理研究提供了理想的生物相关平台。本研究中,Tau PFFs成功诱导脑类器官出现Tau蛋白过度磷酸化、聚集及胶质细胞活化等AD标志性病理特征,从而构建了一个具有高度人类相关性的研究体系,为揭示Tau病理传播机制和开展药物筛选提供了重要工具。
为了建立生理成熟的类器官模型,我们使用脑类器官分化试剂盒(货号:RIPO-BWM001K)生成了来源于iPSC的脑类器官(货号:CIPO-BWL002K),并将其培养超过100天。这些类器官展示出类似皮质II至VI层的有序层状结构,同时表达了多种关键神经元和胶质细胞标记物,包括谷氨酸能神经元、GABA能神经元、多巴胺能神经元,以及星形胶质细胞和少突胶质细胞(图1)。这些结果表明,所生成的脑类器官具有较高的成熟度和细胞异质性。
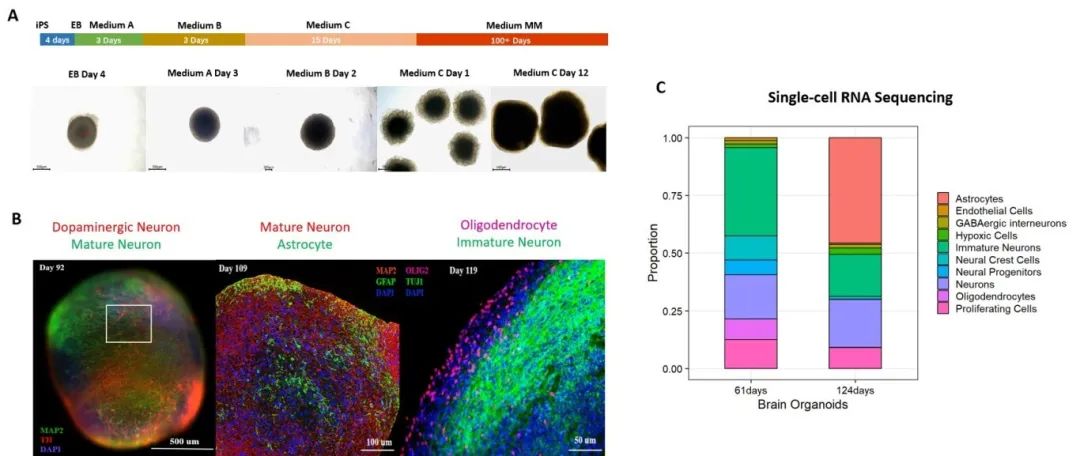
图 1. (A) 脑类器官分化过程示意图。(B) 免疫染色与 (C) 单细胞 RNA 测序结果证实,在培养超过100天的脑类器官中,成熟神经元和胶质细胞标志物具有显著表达。
为了评估外源性Tau蛋白“种子”效应,我们将培养超过100天的脑类器官分别用浓度为10 μg/mL或100 μg/mL的Tau PFFs(货号:TAU-H5113 / TAU-H5116)进行处理。培养持续10天,每5天更换一次培养基。处理5天后,我们观察到类器官中出现凋亡细胞,且在100 μg/mL的浓度下,类器官周围出现明显的细胞碎片(图2)。这一结果表明,Tau PFFs具有浓度依赖性的细胞毒性效应。
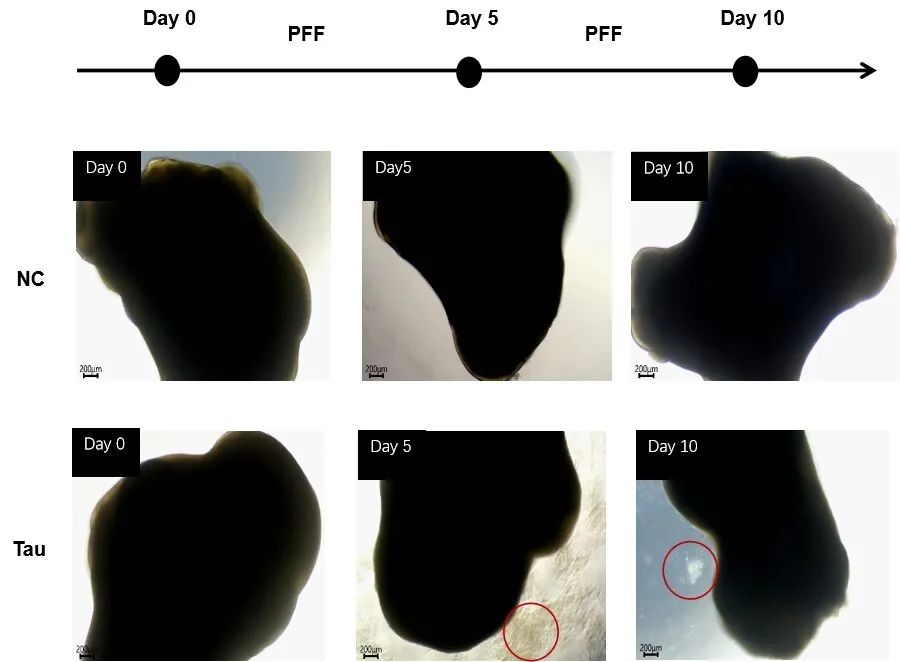
图2. Tau PFFs处理5天后观察到细胞凋亡
为了评估Tau PFFs对Tau病理的影响,我们将脑类器官与Tau PFFs共培养,并评估磷酸化Tau(p-Tau)的积累情况。免疫染色结果显示,处理后p-Tau181(图 3)和AT8(图 4)水平显著升高。进一步的蛋白质印迹分析表明,随着Tau PFFs浓度的增加,p-Tau217水平也逐步上升(图 5)。结果表明,Tau PFFs通过诱导内源性Tau蛋白的磷酸化及种子依赖性传播,复现了AD的关键病理特征1-5。
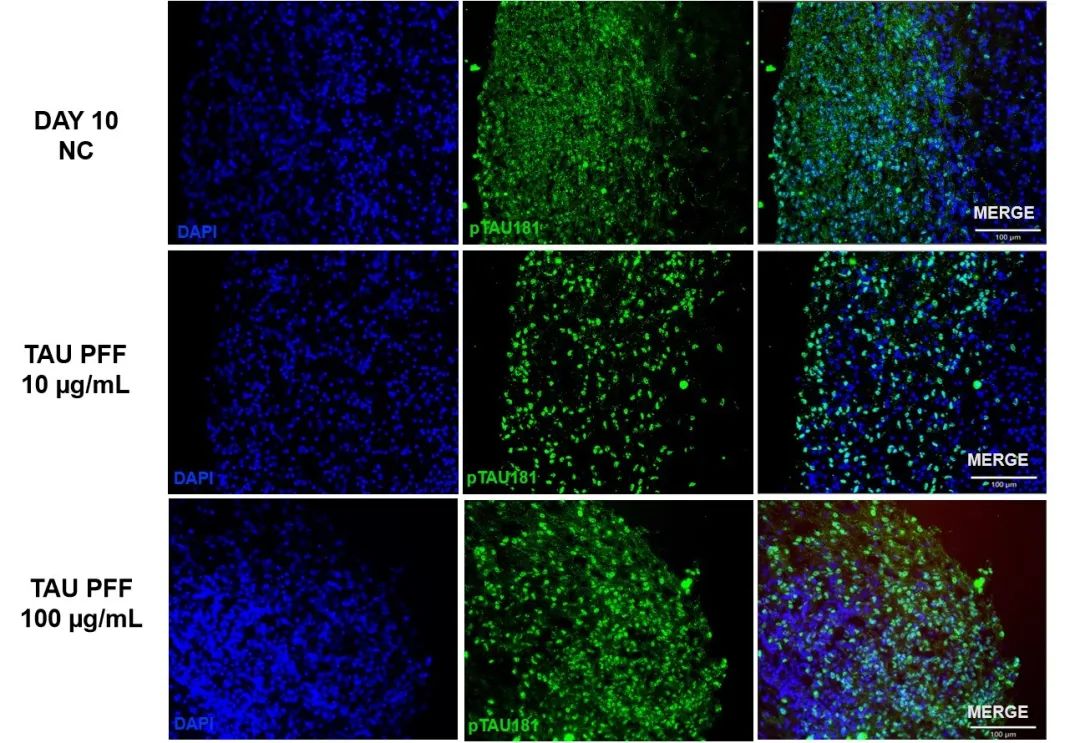
图 3. Tau PFFs 处理后p-Tau181表达升高
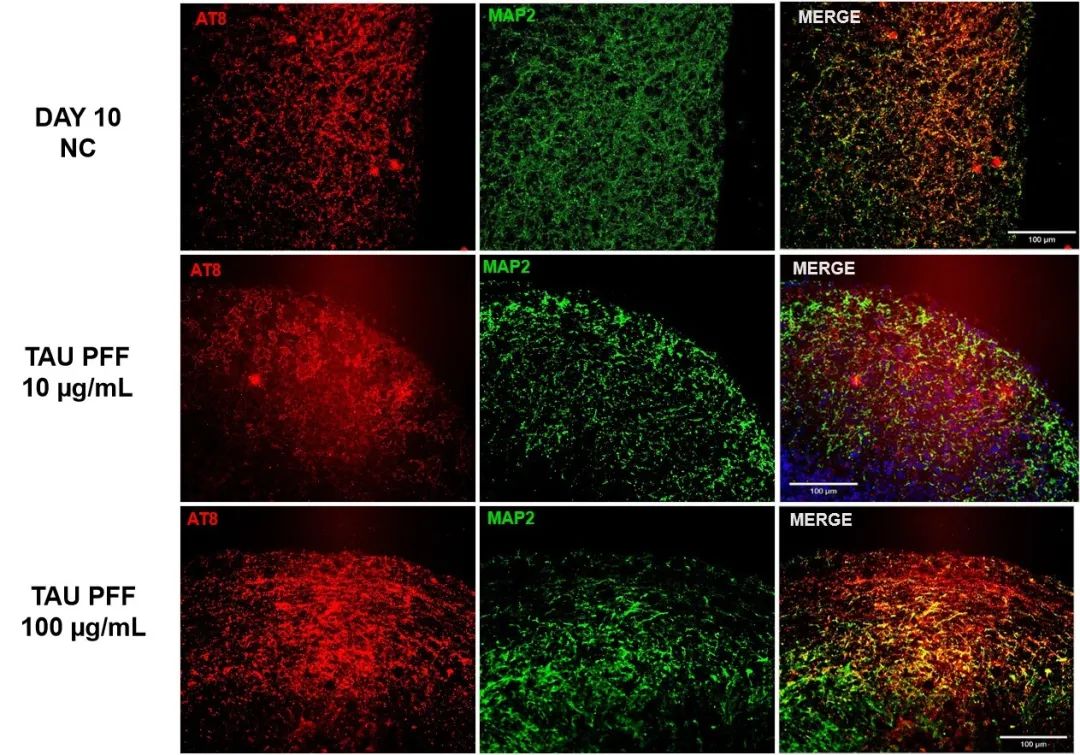
图 4. Tau PFFs 处理后AT8表达升高

图5. Tau PFFs 处理后p-Tau217表达升高
为了评估Tau PFFs处理后星形胶质细胞的活化情况,我们检测了脑类器官中GFAP和S100β的表达水平。结果显示,处理后GFAP的表达显著上升,尤其是在100 μg/mL的条件下更为明显(图6),其信号从类器官表面延伸至更深的层次,表明出现了反应性星形胶质细胞增生。而中枢神经系统特异性的星形胶质细胞标志物S100β,在100 μg/mL的条件下也表现出较高的表达水平,并伴随有深层浸润现象(图7)。结果表明,高剂量的Tau PFFs可能诱导星形胶质细胞显著活化,并引发脑类器官中的早期神经炎症反应5-6。
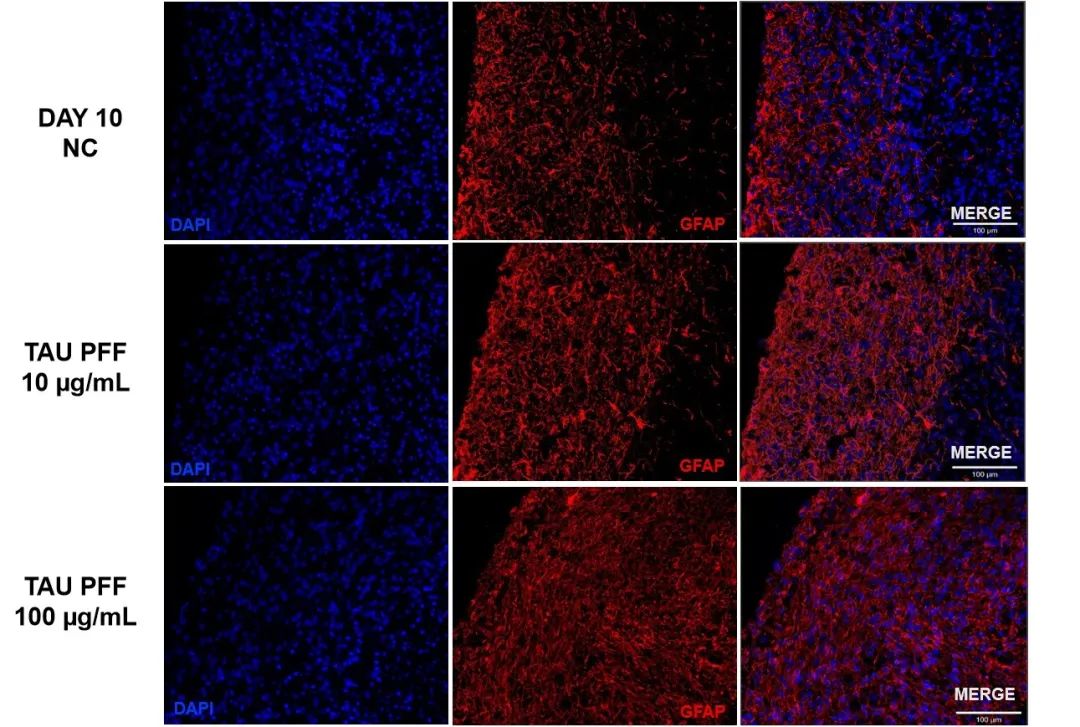
图 6. Tau PFFs 处理后 GFAP 表达升高,信号分布范围扩大并向类器官更深处延伸,表明星形胶质细胞活化增强
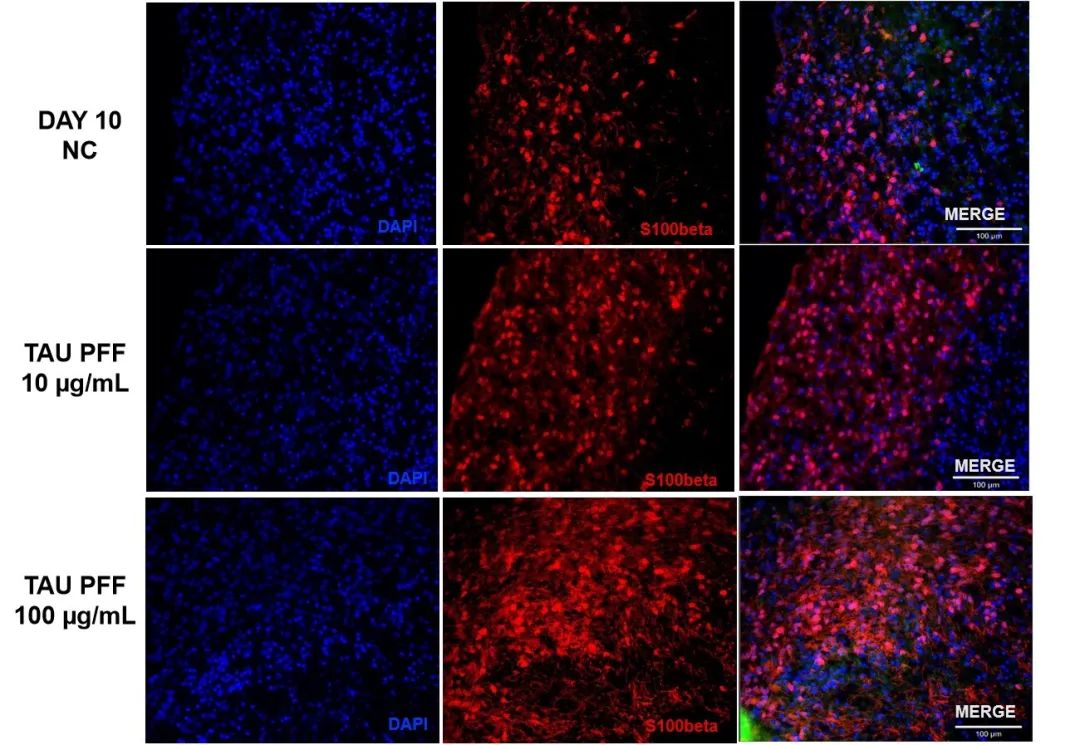
图 7. Tau PFFs 处理后 S100β表达同样升高,可能与星形胶质细胞活化及神经炎症反应的启动相关
为了探究Tau PFFs对神经炎症和氧化应激的影响,我们检测了脑类器官中细胞因子的表达及抗氧化反应。结果显示,Tau PFFs处理可上调促炎细胞因子IL-1β、IL-6和IL-8的水平,同时下调线粒体关键抗氧化酶SOD2的表达。升高的IL-1β可能通过激活胶质细胞中的NF-κB信号通路,进一步促进IL-6和IL-8的释放。这种慢性炎症环境可能通过胶质细胞来源的活性氧(ROS)导致神经元损伤,并加剧氧化应激。同时,SOD2的下调可能导致超氧阴离子自由基的积累,从而进一步损害线粒体功能7-9。
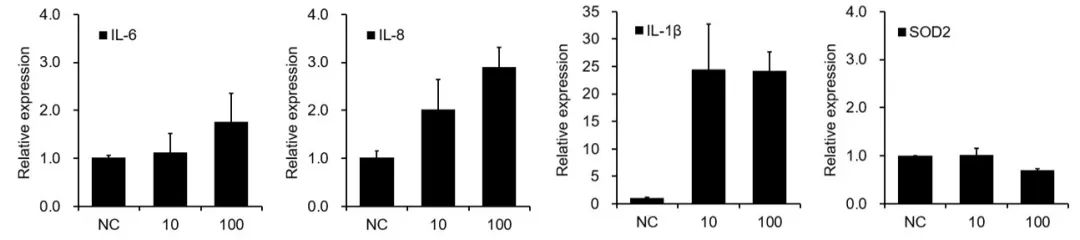
图 8. Tau PFFs诱导神经炎症并破坏抗氧化平衡
我们建立了一种Tau PFFs-脑类器官共培养模型,该模型能够有效重现AD及相关Tau蛋白病的核心病理特征。外源性Tau PFFs能在脑类器官内有效播种病理,诱导Tau蛋白在疾病相关位点(包括p-Tau181、p-Tau217和AT8)发生剂量依赖性的过度磷酸化。此外,Tau PFFs暴露会导致显著的星形胶质细胞活化,表现为GFAP和S100β表达升高。相关的病理变化从类器官表面逐渐向更深层的皮质区域扩散,反映了星形胶质细胞活化在组织层次间的空间分布模式。活化的胶质细胞可能通过诱导NF-κB介导的促炎细胞因子(如 IL-1β、IL-6 和 IL-8)上调,导致慢性神经炎症和神经元易感性增加。SOD2的下调进一步引起ROS累积和线粒体功能障碍,在炎症和氧化应激之间形成恶性循环,加剧神经元损伤和凋亡。
人源脑类器官弥补了传统二维细胞模型和动物模型的不足,为研究Tau蛋白聚集与传播、神经炎症与氧化应激的相互作用以及胶质细胞与神经元之间的关系提供了一个更具病理相关性的研究平台。此外,该模型还可以用于筛选针对Tau种子传播、炎症通路(如IL-1β/NF-κB)或线粒体氧化还原失衡(如SOD2调节剂)的潜在治疗化合物。总体来说,该模型为神经退行性疾病的机制研究和转化医学研究提供了一个强有力的工具。



>>点击图片,了解预制前体纤维(PFFs)
细胞因子在自身免疫疾病中的治疗潜力(8月28日)

本课程聚焦自身免疫疾病药物开发前沿,以细胞因子为核心,深度解析关键白介素靶点在疾病发生发展中的动态调控与治疗潜力,并结合前沿技术与案例,系统阐述自身免疫疾病药物开发策略。通过典型成功与失败案例对比,剖析靶点选择、验证及候选药物开发的核心考量,并探讨前沿技术的应用,助力突破细胞因子药物开发的科学难题,推动自身免疫疾病创新疗法发展。
参考文献
1. Rawat P, Sehar U, Bisht J, Selman A, Culberson J, Reddy PH. Phosphorylated Tau in Alzheimer's Disease and Other Tauopathies. Int J Mol Sci. 2022;23(21):12841. doi:10.3390/ijms232112841
2. Kaufman SK, Sanders DW, Thomas TL, et al. Tau Prion Strains Dictate Patterns of Cell Pathology, Progression Rate, and Regional Vulnerability In Vivo. Neuron. 2016;92(4):796-812. doi:10.1016/j.neuron.2016.09.055
3. Sanders DW, Kaufman SK, DeVos SL, et al. Distinct tau prion strains propagate in cells and mice and define different tauopathies. Neuron. 2014;82(6):1271-1288. doi:10.1016/j.neuron.2014.04.047
4. Liu F, Huang J, Zhang L, et al. Advances in Cerebral Organoid Systems and their Application in Disease Modeling. Neuroscience. 2019;399:28-38. doi:10.1016/j.neuroscience.2018.12.013
5. Vogel JW, Iturria-Medina Y, Strandberg OT, et al. Spread of pathological tau proteins through communicating neurons in human Alzheimer's disease [published correction appears in Nat Commun. 2021 Aug 5;12(1):4862. doi: 10.1038/s41467-021-25193-3.]. Nat Commun. 2020;11(1):2612. Published 2020 May 26. doi:10.1038/s41467-020-15701-2
6. Michetti F, Clementi ME, Di Liddo R, et al. The S100B Protein: A Multifaceted Pathogenic Factor More Than a Biomarker. Int J Mol Sci. 2023;24(11):9605. Published 2023 May 31. doi:10.3390/ijms24119605
7. Kummer KK, Zeidler M, Kalpachidou T, Kress M. Role of IL-6 in the regulation of neuronal development, survival and function. Cytokine. 2021;144:155582. doi:10.1016/j.cyto.2021.155582
8. Vilotić A, Nacka-Aleksić M, Pirković A, Bojić-Trbojević Ž, Dekanski D, Jovanović Krivokuća M. IL-6 and IL-8: An Overview of Their Roles in Healthy and Pathological Pregnancies. Int J Mol Sci. 2022;23(23):14574. Published 2022 Nov 23. doi:10.3390/ijms232314574
9. Flynn JM, Melov S. SOD2 in mitochondrial dysfunction and neurodegeneration. Free Radic Biol Med. 2013;62:4-12. doi:10.1016/j.freeradbiomed.2013.05.027
ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)



